Ancylostoma duodenale
|
|
Cet article ne cite pas suffisamment ses sources (juin 2007). Si vous disposez d'ouvrages ou d'articles de référence ou si vous connaissez des sites web de qualité traitant du thème abordé ici, merci de compléter l'article en donnant les références utiles à sa vérifiabilité et en les liant à la section « Notes et références » (modifier l'article, comment ajouter mes sources ?).
|
| Règne | Animalia |
|---|---|
| Embranchement | Nematoda |
| Classe | Secernentea |
| Ordre | Strongylida |
| Famille | Ancylostomidae |
| Genre | Ancylostoma |
Ancylostoma duodenale
(Dubini, 1843)
Ancylostoma duodenale est une espèce de nématodes (les nématodes sont un embranchement de vers non segmentés, recouverts d'une épaisse cuticule et menant une vie libre ou parasitaire).
Deux petits vers ronds très voisins, Ancylostoma duodenale et Necator americanus, sont désignés couramment par le même nom d'ankylostome car ils entraînent, par leur présence dans le duodéno-jéjunum de l'homme, une seule et même maladie : l'ankylostomose.
Histoire
Ce parasite est connu depuis plus d'un siècle.
Il fait partie de ceux qui étaient au début du XXe siècle considérés comme d'introduction interdite aux États-Unis(classé maladies contagieuses dangereuses). En vertu de la loi sur l'immigration (Immigration Act), l'admission des étrangers aux États-Unis nécessitait un examen médical conduit par des agents des services de santé publique (du service hostpitalier de la marine), visant notamment à empêcher l'introduction d'ankylostomes par des étrangers immigrants arrivant au port de San Francisco. Un examen de routine des selles des étrangers passant par la station de l'immigration d'Angel Island a été tenté, bien qu'impossible à appliquer à tous les immigrants[1].
Répartition géographique et importance
Parmi les 1300 millions de personnes infectées par ces deux vers, 150 millions seraient gravement atteintes de cette verminose cosmopolite, occasionnant 65000 décès annuels, selon l'OMS[2].
Atteignant, dans certaines zones chaudes et humides, des taux d'infestation de 90 à 95 %[réf. nécessaire], l'ankylostomose est l'une des maladies majeures du monde moderne par ses conséquences sur le plan social : l'anémie, l'amyotrophie et l'aboulie, qu'elle entraîne dans les populations massivement parasitées, participant sous-développement des régions de haute endémicité.
D'autre part, cette verminose nous permet de saisir l'étrange disproportion entre l'exiguïté de son agent causal, l'ankylostome, et le large éventail de pouvoirs pathogènes qu'il possède :
- sa bouche armée lèse la muqueuse, entraînant duodénite (inflammation du duodénum) et arrêt d'absorption des vitamines B, d'où polynévrite ;
- son hématophagie "saigne" le malade : 0,5 ml par ver et par jour, soit 0,5 litre pour 1 000 vers
- les hémolysines de sa salive anticoagulante prolongent les micro-hémorragies de la muqueuse lésée, rendant la perte sanguine très notable ;
- les toxines sécrétées par ses glandes céphaliques et salivaires modifient le métabolisme du fer, entravant la maturation des érythrocytes et font chuter le taux d'hémoglobine ;
- l'anémie résultante se montre extrêmement sévère chez les malades de peau blanche (autour de 1 million de globules rouges par mm³), alors qu'elle l'est beaucoup moins chez les malades de peau noire (autour de 3,8 millions de GR/mm³) sans que l'on sache la raison de cette différence.
Morphologie
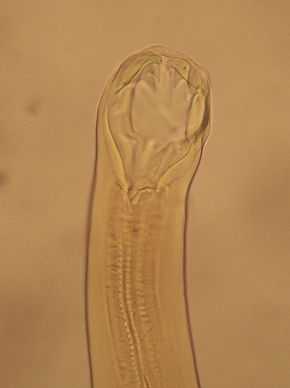
Très petits vers ronds d'une teinte blanchâtre ou rosée, plus effilés vers l'avant, les ankylostomes mesurent seulement 1 cm pour le mâle et 1,5 cm pour la femelle ; une capsule buccale fortement armée garnit leur tête. Le dimorphisme sexuel est net, la femelle se terminant en pointe (mousse?) alors que l'extrémité postérieure du mâle s'évase en une bourse copulatrice.
Biologie
.gif)
Les adultes vivent dans le duodéno-jéjunum (partie de l'intestin grêle qui fait suite au duodénum) de l'homme ; fixés par leurs crochets buccaux à la muqueuse qu'ils "broutent", ils peuvent vivre des années, 5 et plus, et leur nombre peut être considérable chez un même individu, 500 à 3 000. Ils se nourrissent de sang dont ils assimilent le plasma.
Après fécondation, la femelle se met à pondre, dans la lumière intestinale, une moyenne de 10 000 œufs par jour ; ces œufs, émis avec les selles, ont, à ce moment, un aspect caractéristique (indifférenciable pour A. duodénale et N. americanus) : ellipsoïdes, à coque mince, ils mesurent 60 microns sur 40 microns et contiennent 4 à 8 blastomères.
Le cycle évolutif est à un seul hôte, l'homme, mais avec stade de vie obligatoire, avec stade libre et migration. Arrivés dans un milieu favorable (terre humide) avec la selle qui les contient, les œufs terminent leur évolution et laissent sortir une larve qui, après deux mues, devient la larve strongyloïde enkystée infectieuse. Fuyant la terre, cette larve grimpe sur les herbes humides, jusqu'à 30 cm, ou sur les parois mouillées des mines et tunnels, jusqu'à 90 cm ou 1 m, et y attend le passage de son hôte définitif, l'homme. Dès qu'une peau humaine, jambe ou main en général, arrive à son contact, elle s'y fixe, la traverse et, par voie sanguine ou lymphatique, gagne le cœur droit et le poumon ; passant dans un alvéole, elle remonte les voies aériennes, atteint le carrefour aéro-digestif, est déglutie, descend jusqu'au duodénum où elle se fixe à la muqueuse et devient adulte. Entre la pénétration transcutanée et la première ponte de la femelle, 5 à 6 semaines s'écoulent.
Il faut savoir que certaines conditions sont nécessaires à l'obtention du cycle libre : apport d'œufs par défécation au grand air (et emploi d'engrais humain); terre humide, riche, chaude et ombragée, celle des bourbiers des sous-bois tropicaux, celle des galeries de mines, chantiers de tunnel, briqueteries, solfatares ou rizières. Ainsi s'explique la distribution géographique : énormes foyers endémiques des régions tropicales et subtropicales, foyers localisés ou sporadiques des climats tempérés.
Clinique
Paradoxalement, les aspects cliniques de l'ankylostomose ont été, tout d'abord, décrits en Europe, dans les régions minières, sous le nom d'anémie des mineurs. Cette maladie professionnelle (qui, nous l'avons vu ne se limite pas aux seules mines) a pratiquement disparu grâce à des mesures de surveillance draconiennes ; pourtant les bouffées sporadiques apparaissant dans des chantiers, comme lors de la construction du tunnel du Mont Blanc, montrent la nécessité du maintien de ces mesures.
Trois tableaux cliniques se succèdent dans l'ankylostomose, les deux premiers traduisant l'action des stades larvaires, le dernier, celle des adultes :
La période d'infestation
La période d'infestation, lors de la pénétration trans-cutanée des larves, a un tableau de dermatose : la gale de terre ; aux pieds surtout, dans les espaces interdigitaux, puis aux mains, au pli du coude, ce sont des piqûres suivies de chatouillements, puis apparaissent des maculopapules, des placards érythémateux, durant de quelques heures à quelques jours ; les réinoculations constantes et les lésions de grattage en font une dermatose chronique avec eczématisation, lichénification aboutissant, dans les mines, aux nodules rouges de la gourme des mineurs, sous les tropiques, aux suppurations et au phagédénisme.
La période d'invasion
La période d'invasion, pendant le transit des larves à travers l'appareil respiratoire, avec un tableau d'affection broncho-pulmonaire (catarrhe des gourmes), se ramène à un syndrome de Löffler atypique : pseudo-bronchite avec toux quinteuse et voix rauque, sans signes d'auscultation ; absence d'infiltrats pulmonaires labiles à la radiographie, sauf dans quelques infestations très massives ; crises urticariennes ; hyperleucocytose avec éosinophilie élevée à 40 % et plus. Cette période débute vers le 8e jour après le contage.
La période d'état
La période d'état, 8 à 15 jours plus tard, est celle du parasitisme intestinal par les vers adultes ; c'est l'ankylostomose proprement dite dont le tableau traduit 4 ordres de troubles : digestifs, anémiques, nerveux et généraux.
- Les troubles digestifs consistent en gêne épigastrique, douleurs épigastriques irradiant vers l'épaule gauche ou la fosse iliaque gauche, calmées ou exacerbées par la prise d'aliments ; troubles dyspeptiques constants (mal-cœur des Antillais), avec modification de l'appétit, inappétence et faims nerveuses amenant aux perversions du goût et au géophagisme ; régurgitations, nausées, aérogastrie ; puis, plus tard, troubles intestinaux : météorisme abdominal, alternance de diarrhées et de constipation, puis de selles pâteuses et de diarrhée séreuse, enfin melaena dû à la fois au sang provenant des lésions et aux hématies rejetées par les vers.
- Les troubles anémiques, constants, s'installent insidieusement : sécheresse de la peau qui se décolore chez le Blanc et se ternit chez le Noir ; décoloration des muqueuses ; œdème péri-malléolaire remontant le long du membre inférieur ; accélération du pouls, palpitations, dyspnée d'effort, bourdonnements d'oreille, vertiges et épistaxis. L'auscultation permet d'entendre, dans un cœur dilaté, des souffles anémiques. L'examen du sang montre : une chute du taux des hématies à 1 million ou moins, avec polychromatophilie, anisocytose, microcytose, réticulocytes et anneaux de Cabot ; une hypochromie avec taux d'hémoglobine inférieur à 25 % ; une leucocytose modérée, mais une éosinophilie revenue vers 10 à 20 %. Cette anémie peut aboutir à des cardiopathies diverses.
- Les troubles nerveux sont fréquents : céphalées et insomnie ; troubles paresthésiques, engourdissements, fourmillements, refroidissement des membres ; troubles moteurs, hypotonie musculaire, troubles de la marche avec ébauche d'incoordination motrice, puis abolition des réflexes ; amyotrophie importante qui, masquée par l'œdème, doit être recherchée soigneusement. Parfois on arrive au type polynévritique et à des paraplégies.
- Les troubles généraux consistent en poussées fébriles à 38 - 38,5 °C, crises polyuriques avec légère albuminurie, aménorrhée chez la femme, impuissance chez l'homme, arrêt de la croissance et de l'évolution psychique chez l'enfant, diminution intellectuelle avec amnésie, aboulie et dépression mentale chez l'adulte.
Évolution
L'évolution dépend de l'intensité du parasitisme et du mode de vie du malade : les sujets avec moins de 25 vers sont des porteurs sains, les malades hébergeant de 25 à 500 vers sont améliorables par le traitement, ceux qui dépassent ce chiffre et arrivent à des taux de 3 000 et plus font une forme dite maligne, à pronostic très sombre, amenant à la cachexie et la mort par affection intercurrente. De même, alors qu'un voyageur, infecté accidentellement à son passage en zone d'endémie, sera spontanément déparasité à 80 % en un an dès son retour en région saine, l'autochtone d'un foyer important, dont la faune parasitaire va augmenter régulièrement de 50 vers par an sous l'influence des réinfestations constantes, s'achemine inéluctablement vers une forme maligne aboutissant à la cachexie et à la mort.
Diagnostic
Le diagnostic des deux premières périodes se fait rarement sans la notion de contage possible, dans une zone d'endémie ; à la période d'état, le diagnostic clinique est surtout celui des anémies. La constatation d'une éosinophilie élevée, atteignant 60 à 70 % au cours du premier mois, doit faire rechercher une parasitose ; le diagnostic de certitude sera donné par la découverte des œufs caractéristiques dans les selles avec un examen parasitologique (par examen direct ou après enrichissement) et surtout par celles des larves après coproculture qu'il faut demander expressément au laboratoire.
Traitement
L'ankylostome peut être traité localement par cryothérapie quand il est toujours dans la peau. Le Mébendazole (100 mg 2 fois par jour pendant 3 jours) est efficace à l'étape intestinale et pendant l'étape où le parasite migre toujours sous la peau. En cas d'anémie, la supplémentation en fer peut atténuer les symptômes de l'anémie ferriprive. Cependant, lorsque le taux de globules rouges revient à la normale, le manque d'autres substances comme l'acide folique ou la vitamine B12 peut apparaître qui peuvent également nécessiter une supplémentation.
Chez l'enfant, après le déparasitage, une amélioration de l'état de santé est constatée dans les deux mois, et après un an, les formules sanguines sont redevenues normales[3].
Des tests de vaccination sont en cours[4],[5]
Prévention, prophylaxie individuelle et hygiène
La médication a progressé[6], et certains succès ont été obtenus, dont par exemple en Corée[7].
L'OMS propose des moyens de suivi[8] et de prévention[9],[10], notamment chez les enfants[11]. Le port de chaussures montantes, surtout dans les zones boueuses, suffit à prévenir la transmission. Nettoyage et séchage immédiat et vigoureux de la peau en cas de contact avec la boue.
Des cartes de risques peuvent être faites et diffusées[12].
Cependant, après les campagnes de médication, le risque de réinfection est toujours élevé en zone d'endémie, notamment chez les enfants[13].
On a montré que l'éducation à l'hygiène était nécessaire, de même que la prise en compte su contexte socioéconomique des familles et groupes concernés[14],[15],Ugbomoiko US, Dalumo V, Ofoezie IE, Obiezue RNN (2009) Socio-environmental factors and ascariasis infection among school-aged children in Ilobu, Osun State, Nigeria. Trans R Soc Trop Med Hyg 103: 223–228.. Les campagnes massives même sur 10 ans de vermifugeage sont suivies d'une reprise des infestations sans mesures strictes d'hygiène [16].
Aspects zoonotiques
Une étude récente (2012)[17] a utilisé en Malaisie des moyens d'analyse classiques et moléculaires permettant de discriminer les différentes espèces d'ankylostome, ce que ne permet pas l'examen microscopique classique des selles. Des outils épidémiologiques ont été associés pour déterminer le rôle possible des animaux domestiques. L'étude a confirmé que l'infection par Ancylostoma ceylanicum est fréquente chez les populations humaines en Malaisie et que les chiens et chats contribuent à la propagation et transmission de l'ankylostome dans les communautés pauvres[17].
Voir aussi
Articles connexes
- Parasitologie
- Parasitisme
- nématode
- Nématologie
- Nématicide
Liens externes
- (fr)
- Cette section est vide, insuffisamment détaillée ou incomplète. Votre aide est la bienvenue !
Bibliographie
- (en) Hotez, P. J., and D. I. Pritchard. (juin 1995), Hookworm infection. Sci. Am. 272:68–74.
- (en) Hotez PJ, Bundy DAP, Beegle K, Brooker S, Drake L, et al. (2006), Helminth infections: soil-transmitted helminth infections and schistosomiasis. In: Jamison DT, Breman JG, Measham AR, Alleyne G, Claeson M, et al., editors. Disease Control Priorities in Developing Countries. New York: Oxford University Press and World Bank. p. 467–482.
- (en) Knopp S, Mohammed KA, Rollinson D, Stothard JR, Khamis IS, Utzinger J, Marti H (2009), Changing patterns of soil-transmitted helminthiases in Zanzibar in the context of national control programs. Am J Trop Med Hyg 81: 1071–1078.
- (en) Looss, A. 1898. Zur Lebensgeschichte des Ankylostoma duodenale. Cbt. Bakt. 24:441–449, 483–488.
- (en) Murray, P. R., K. S. Rosenthal, and M. A. Pfaller. (2009), Medical Mirobiology, 6th ed. Elsevier/Mosby Publishing Company, Philadelphia, U.S.A., 865 p.
- (en) Schmidt, G.D., and L. S. Roberts (2009), Foundations of parasitology, 8th ed. McGraw-Hill Companies, New York, p. 472–473.
Références
- ↑ M. W. GLOVER, M.D., Hookworm among oriental immigrants (résumé)
- ↑ (en) Partnership for Parasite Control, Second Meeting Rome, avril 2002
- ↑ Mahidol University (Thailande) Iimpact of hookworm deworming on anemia and nutritional status among children in thailand Vol 42 no 4, juillet 2011
- ↑ NCBI, Developing vaccines to combat hookworm infection and intestinal schistosomiasis, 2011
- ↑ IDRI (2012-01-31) Supports the First Phase 1 Human Hookworm Vaccine Clinical Trial
- ↑ Keiser J, Utzinger J (2008) Efficacy of current drugs against soil-transmitted helminth infections: systematic review and meta-analysis. JAMA 299: 1937–1948.
- ↑ Hong S-T, Chai J-Y, Choi M-N, Huh S, Rim H-J, Lee S-H (2006) A successful experience of soil-transmitted helminth control in the Republic of Korea. Korean J Parasitol 44: 177–185
- ↑ Ash LR, Orihel TC, Savioli L, Sin MA, Montresor A, et al. (1998) Training Manual on Diagnosis of Intestinal Parasites. Geneva: World Health Organization.
- ↑ World Health Organization (2006) Preventive Chemotherapy in Human Helminthiasis. Geneva: World Health Organization. 62 p.
- ↑ World Health Organization (WHO). Prevention and control of schistosomiasis and soil-transmitted helminthiasis : report of a WHO expert committee. WHO Techn Rep Ser 1981: 912.
- ↑ Montresor A, Crompton DWT, Gyorkos TW, Savioli L (2002) Helminth control in school-age children: A guide for managers of control programmes. Geneva: World Health Organization.
- ↑ Krivoruchko K, Gotway CA (2004) Creating exposure maps using kriging. Public Health GIS News and Information No 56. Accessed at http://rpmconsulting.com/cdcgis56.pdf on 21.07.2011.
- ↑ Albonico M, Smith PG, Ercole E, Hall A, Chwaya HM, Alawi KS, Savioli L (1995) Rate of reinfection with intestinal nematodes after treatment of children with mebendazole or albendazole in a highly endemic area. Trans R Soc Trop Med Hyg 89: 538–541
- ↑ de Silva NR, Jayapani VPP, de Silva HJ (1996) Socioeconomic and behavioural factors affecting the prevalence of geohelminths in preschool children. Southeast Asian J Trop Med Public Health 27: 36–42
- ↑ Quihui L, Valencia ME, Crompton DWT, Phillips S, Hagan P, et al. (2006) Role of the employment status and education of mothers in the prevalence of intestinal parasitic infections in Mexican rural schoolchildren. BMC Public Health 6: 225
- ↑ Gunawardena K, Kumarendran B, Ebenezer R, Gunasingha MS, Pathmeswaran A, et al. (2011) Soil-Transmitted Helminth Infections among Plantation Sector Schoolchildren in Sri Lanka: Prevalence after Ten Years of Preventive Chemotherapy. PLoS Negl Trop Dis 5(9): e1341. doi:10.1371/journal.pntd.0001341
- 1 2 Ngui R, Lim YAL, Traub R, Mahmud R, Mistam MS (2012) Epidemiological and Genetic Data Supporting the Transmission of Ancylostoma ceylanicum among Human and Domestic Animals. PLoS Negl Trop Dis 6(2): e1522.
- Portail de la zoologie
- Portail de la parasitologie
