Acide aspartique
|
|
Cet article est une ébauche concernant la biochimie et les neurosciences. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants.
Consultez la liste des tâches à accomplir en page de discussion. |
| Acide aspartique | |
|---|---|
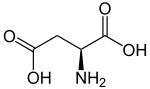 Acide L ou S(+)-aspartique  Acide D ou R(-)-aspartique | |
| Identification | |
| Nom UICPA | acide (2S)-2-aminobutanedioïque |
| Synonymes | D, Asp |
| No CAS | (racémique) (L) ou S(+) (D) ou R(–) |
| No EINECS | (L) (D) |
| FEMA | |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores[1]. |
| Propriétés chimiques | |
| Formule brute | C4H7NO4 [Isomères] |
| Masse molaire[2] | 133,1027 ± 0,0051 g/mol C 36,09 %, H 5,3 %, N 10,52 %, O 48,08 %, |
| pKa | 2,0 10,0 3,9 |
| Propriétés physiques | |
| T° fusion | 270 °C[1] |
| T° ébullition | Se décompose au-dessous du point d'ébullition à 324 °C[1] |
| Solubilité | dans l'eau : 4,5 g·l-1[1] |
| Masse volumique | 1,7 g·cm-3[1] |
| Propriétés biochimiques | |
| Codons | GAU, GAC |
| pH isoélectrique | 2,77[3] |
| Acide aminé essentiel | Non |
| Occurrence chez les vertébrés | 5,9 %[4] |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | P21 (L)[5] |
| Paramètres de maille | a = 7,617 Å b = 6,982 Å |
| Volume | 269,44 Å3 (L)[5] |
| Densité théorique | 3,281 (L)[5] |
| Propriétés optiques | |
| Pouvoir rotatoire | +5,0 ° .dm-1.g-1.cm³ |
| Précautions | |
Produit non contrôlé | |
| Écotoxicologie | |
| LogP | -3,89[1] |
L’acide aspartique (abréviations IUPAC-IUBMB : Asp et D), est un acide α-aminé dont l'énantiomère L est l'un des 22 acides aminés protéinogènes, encodé sur les ARN messagers par les codons GAU et GAC. Il est caractérisé par la présence d'un groupe carboxyle –COOH à l'extrémité de sa chaîne latérale, lui conférant un point isoélectrique de 2,77, ce qui en fait le résidu le plus acide dans les protéines. Son anion et base conjuguée est l'aspartate et son rayon de van der Waals vaut 2,91 Å.
Il s'agit d'un acide dicarboxylique, et donc d'une molécule polaire. Chez les mammifères, il est non essentiel. C'est un métabolite du cycle de l'urée, il participe à la gluconéogenèse et il joue un rôle de substrat de la voie de biosynthèse des pyrimidines. C'est un neurotransmetteur excitant du cerveau sous sa forme méthylée (N-méthyl-D-aspartate), activant les récepteurs NMDA, qui sont des récepteurs au glutamate[7].
Découverte
L'acide aspartique a été découvert en 1867 par Plisson, à partir de l'asparagine, elle-même isolée du jus d'asperge en 1806, en portant le jus à ébullition avec une base[8].
Acide aspartique et aspartame
L'acide aspartique représente 40 % des produits de dégradation de l’aspartame[9].
Notes et références
- 1 2 3 4 5 6 ACIDE L - ASPARTIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Francis A. Carey, « Table of pKa and pI values », sur Département de chimie de l'université de Calgary, (consulté le 26 juillet 2015)
- ↑ (en) M. Beals, L. Gross, S. Harrell, « Amino Acid Frequency », sur The Institute for Environmental Modeling (TIEM) à l'université du Tennessee (consulté le 26 juillet 2015)
- 1 2 3 4 « Aspartic acid », sur www.reciprocalnet.org (consulté le 12 décembre 2009)
- ↑ « Acide aspartique (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Acide aspartique sur Techno-Science.net.
- ↑ R.H.A. Plimmer (dir.) et F.G. Hopkins (dir.), The chemical composition of the proteins, vol. Part I. Analysis, London, Longmans, Green and Co., , 2nd éd. (1re éd. 1908) (lire en ligne), p. 112.
- ↑ [PDF] julientap.free.fr)
Voir aussi
- aspartate transaminase
Lien externe
- (en) http://www.chemie.fu-berlin.de/chemistry/bio/aminoacid/asp_en.html
- Portail de la biochimie
- Portail de la chimie