Triose-phosphate isomérase
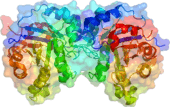
Vue latérale d'un dimère TPI1.
| N° EC | EC |
|---|---|
| N° CAS |
| IntEnz | Vue IntEnz |
|---|---|
| BRENDA | Entrée BRENDA |
| IUBMB | 5.3.1.1 à l'IUBMB |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | Structures |
| GO | AmiGO / EGO |
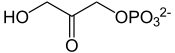
La triose-phosphate isomérase (TPI) est une enzyme intervenant dans la 5e étape de la glycolyse pour catalyser l'isomérisation réversible de la dihydroxyacétone phosphate (DHAP) en D-glycéraldéhyde-3-phosphate (G3P) :
- {| align="left"
|- align="center" valign="middle"
|  |
|  |
|  |- align="center" valign="middle"
| Dihydroxyacétone phosphate
|
| D-glycéraldéhyde-3-phosphate
|- align="center" valign="middle"
| Dihydroxyacétone phosphate
|
| D-glycéraldéhyde-3-phosphate
|}
Ainsi, chaque molécule de β-D-fructose-1,6-bisphosphate métabolisée par la glycolyse donne en fin de compte deux molécules de D-glycéraldéhyde-3-phosphate.
La TPI est un dimère de deux sous-unités identiques d'environ 250 acides aminés. Elle a été trouvée dans presque tous les organismes dans laquelle elle a été recherché, des bactéries aux animaux en passant par les plantes et les mycètes. Seules quelques bactéries qui ne possèdent pas le matériel enzymatique nécessaire à la glycolyse ne disposent pas non plus de TPI, par exemple le genre Ureaplasma.
Cette enzyme est très efficace, accélérant la réaction plusieurs milliards de fois par rapport à sa vitesse naturelle : la vitesse de cette réaction n'est limitée que par celle à laquelle substrats et produits peuvent circuler autour du site actif.
- Portail de la biochimie
- Portail de la médecine