Optogénétique
L'optogénétique correspond à un nouveau domaine de recherche et d’application, associant l’optique à la génétique. L’optogénétique, élue méthode de l’année d’après Nature Methods 2010, permet de rendre des neurones sensibles à la lumière en combinant le génie génétique et l’optique. Elle permet de stimuler spécifiquement un type cellulaire en laissant les cellules voisines intactes. Cela dans le but de pouvoir un jour cartographier l’ensemble des réseaux neuronaux. En effet le fonctionnement des neurones est encore mal connu, en particulier la physiologie des réseaux neuronaux et la communication entre ces réseaux.
Principe
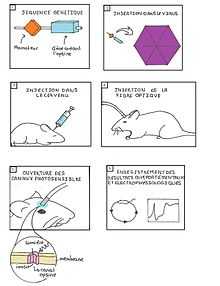
Tout d'abord, pour comprendre le fonctionnement de base de l'optogénétique, il faut connaître un minimum celui du cerveau et plus particulièrement des neurones. Le système nerveux fonctionne avec des signaux électriques. Les neurones codent l'information en signaux électriques ou potentiels d'action. Ces impulsions engendrent la libération de molécules appelées neurotransmetteurs par la cellule nerveuse. Ces messagers chimiques activent alors, ou inhibent les cellules faisant partie du même réseau que cette cellule.
Génétique
Le fonctionnement de l’optogénétique repose principalement sur l’insertion au niveau cérébral des gènes codant pour une protéine « photo-activable » le plus souvent d’origine bactérienne, appelée opsine. L’insertion dans le génome de la séquence codant l’opsine peut être réalisée par deux méthodes différentes [1] :
- L’implantation du génome grâce à un virus définissant un vecteur viral. La particule virale infectera ensuite les cellules de la zone où elle sera injectée. Sous le contrôle d’un promoteur fort et ubiquitaire, ces vecteurs s’intègrent dans le génome hôte des cellules infectées ceci permettant la synthèse d’une quantité suffisante de protéine y compris dans les prolongements les plus fins des cellules.
- La génération d’animaux transgéniques où la molécule photoactivable est insérée dans le génome hôte sous contrôle d’un promoteur spécifique d’un type cellulaire. Cependant ce promoteur est rarement assez fort pour permettre l’expression d’une quantité de protéine suffisante.
Optique
Une fois les opsines produites par l’individu hôte, elles sont alors activées par une lumière particulière (à une certaine longueur d’onde), à l’aide d’une fibre optique directement implantée dans le cerveau de l’animal. Les canaux que forme l’opsine s’ouvrent et, en fonction de leur nature, peuvent provoquer la dépolarisation ou l’hyperpolarisation du neurone. Cela conduit à l’observation de résultats comportementaux et à des enregistrements électrophysiologiques. La technique recourt à toute une diversité d’opsines dont les deux principales sont [2] :
- La channelrhodopsine 2 (ChR2), dont le gène est tiré d’algues unicellulaires, s’ouvre en lumière bleue, laissant entrer les ions Na+ dans les neurones, ce qui les dépolarise, et les rend excitables.
- L’halorhodopsine (NpHR), dont le gène est tiré d’archéobactéries, s’ouvre en lumière jaune, laissant entrer les ions Cl- dans les neurones, ce qui les hyperpolarise, et les rend, à l’inverse, inexcitables.
Historique
Depuis longtemps, les scientifiques tentent de comprendre comment fonctionne le cerveau, notamment son intervention dans la mise en place des mouvements. Tous les travaux visant à stimuler et à visualiser l’activité neuronale ont participé à l’avènement de l’optogénétique.
- 1783 : L'anatomiste italien Luigi Galvani utilise l'électricité pour provoquer la contraction de la patte d'une grenouille morte.
- 1937 : Le Britannique Charles Sherrington imagine de représenter l'activité neuronale par des points lumineux.
- 1971 : Les colorants fluorescents sensibles au voltage apparaissent, de plus Stoeckenius et Oesterhelt découvrent que la protéine bactériorhodopsine agit comme une pompe à ion, pouvant être rapidement activée par la lumière visible.
- 1977 : Découverte de l'halorhodopsine par Matsuno-Yagi et Mukohata
- 1979 : Francis Crick suggère que les propriétés de la lumière peuvent servir d'un outil de contrôle intéressant en neurosciences, puisque les médicaments étaient long à agir et que les électrodes ne pouvaient pas être utilisées pour cibler précisément les cellules définies.
- 1980 : Des colorants fluorescents capables de révéler des changements de concentration des ions calcium dans une cellule sont synthétisés.
- 1997 : Les premiers colorants codés génétiquement révèlent l'activité des neurones.
- 2002 : Les premiers activateurs codés génétiquement sont développés : ces protéines stimulent les neurones quand on les expose à la lumière.
Découverte de la channelrhodopsine (ChR2) dans une algue par Hegemann, Nagel et leurs associés
- 2005 : Première utilisation de la lumière pour contrôler le comportement de mouches modifiées génétiquement et qui fabriquent un activateur.
Première étude sur des mammifères par Ed Boyden et Karl Deisseroth avec la channelrhodopsine permettant de découvrir que l'introduction d'un gène microbien d'opsine induit une réponse des neurones sélectionnés
- 2006 : Le terme d'optogénétique est inventé par Nathalie JANEL et Mark J. Schnitzer
- 2007 : Utilisation de la fibre optique en optogénétique
- 2010 : De nombreuses études ont montré que la channelrhodopsine, bactériorhodopsine et halorhodopsine peuvent activer ou inhiber les neurones rapidement et en toute sécurité en réponse à la lumière à diverses longueurs d’ondes.
Conclusion
L'objectif de l'optogénétique est d'avoir un moyen de stimulation précis dans le temps (stimulation et arrêt de la stimulation). L'animal étudié est son propre témoin, contrairement aux techniques de modification génétiques de perte ou de gain de fonctions Souris knock-out. La caractéristique de l'optogénétique est l'introduction de canaux rapidement activés par la lumière et d'enzymes qui permettent une manipulation des évènements électriques et biochimiques très précise dans le temps. Cette technique a en outre permis de meilleures compréhensions de certaines pathologies neurodégénératives comme la maladie de Parkinson[3]
Née dans les neurosciences, cette technique s’étend désormais à tous les types cellulaires et progresse grâce à l’utilisation d’autre type d’opsine tel que la mélanopsine qui induit des changements métaboliques dans tous les types cellulaires. Grâce à cette protéine il est possible de coupler des canaux sensibles à la lumière et des récepteurs couplés aux protéines G pour définir la concentration en second messager intracellulaire, AMPc et IP3 dans les cellules ciblées.
Notes et références
- ↑ La lettre des neurosciences n°40,"Nouveauté en neuroscience" par Philippe Isope et Matilde Cordeo-Erausquin, p.17-19 (PDF)
- ↑ Le monde 27/09/2011,"Optogétique : commander aux cellules par la lumière" par Françoise Ibarrando et Guy Abeille
- ↑ Science vol.324 n°5925,"Optical deconstruction of Parkinsonian Neural circultry" par Viviana Gradinaru, Murtaza Mogri1, Kimberly R. Thompson1, Jaimie M. Henderson and Karl Deisseroth, p.354-359
Bibliographie
- « Method of the Year 2010 », éditorial, Nature Methods, vol. 8, n° 1, p. 1, janvier 2011.
- Olivier Dessibourg, « Contrôler le cerveau avec de la lumière », Le Temps, n° 3909, p. 3, 26 janvier 2011.
- Vidéo sur l'optogénétique
- La Recherche, n°455, septembre 2011. « Des organes passent sous le contrôle lumineux » par Florence Heimburger, p. 8-10
- La recherche, n°460, fevrier 2012. « L'optogénétique gagne tous les organes » par Pascaline Minet, p. 62-64
- La recherche, n°466, novembre 2010. « Modifier le comportement de neurones par la lumière » par Marine Benoiste avec la collaboration du docteur Cédric Bardy de l'institut Pasteur, p. 58-59
- Pour la Science, n°376, février 2009. « De la lumière dans le cerveau » par Gero Miessenböck p. 35-40
- Portail des neurosciences
