Solubilité
|
|
Cet article est une ébauche concernant la chimie. Vous pouvez partager vos connaissances en l’améliorant (comment ?) selon les recommandations des projets correspondants.
|
La solubilité est la capacité d'une substance, appelée soluté, à se dissoudre dans une autre substance, appelée solvant, pour former un mélange homogène appelé solution.
En thermodynamique, la solubilité est une grandeur physique notée s désignant la concentration molaire maximale du soluté dans le solvant, à une température donnée. La solution ainsi obtenue est alors saturée.
Produit de solubilité
Définition et expression
Le produit de solubilité est - dans le cas d'un composé solide ionique - la constante d'équilibre de la réaction de dissolution . Cette constante est notée Ks(T). Elle ne dépend que de la température T et en général elle augmente avec celle-ci. La solubilité s est fonction de ce produit de solubilité et varie dans le même sens. Considérons la réaction suivante :
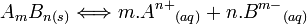
Le produit de solubilité Ks est donné par la relation :  avec
avec 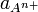 et
et 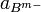 activités des espèces ioniques. Aux faibles concentrations on peut confondre activité et concentration.
Plus le Ks est faible, plus le produit est insoluble.
activités des espèces ioniques. Aux faibles concentrations on peut confondre activité et concentration.
Plus le Ks est faible, plus le produit est insoluble.
Relation entre produit de solubilité et solubilité
Considérons la réaction suivante :m1/v1=m2/v2
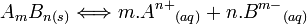
Avec :
| Temps | AmBn | mAn+ | nBm- |
|---|---|---|---|
| t = 0 | c | 0 | 0 |
| t en cours | c - s | m.s | n.s |
On a donc :
Ks = [a(An+)]m x [a(Bm–)]n = (m.s)m x (n.s)n = mm x nn x sn x sm
D'où :
La solubilité s d'une solution s'exprime par : 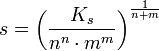
Paramètres influençant la solubilité
En général :
- La polarité ainsi que la présence de liaisons hydrogène dans la molécule influe la dissociation de celle-ci.
- Quand la température de la solution augmente :
- si le soluté est solide, la solubilité augmente ;
- si le soluté est gazeux, la solubilité diminue.
- Quand la pression augmente :
- si le soluté est gazeux, la solubilité augmente.
- sur le point particulier de la solubilité des gaz dans l'eau voir la Loi de Henry
- La solubilité d'un sel est diminuée si un ion de ce sel est déjà présent dans la solution : on appelle cela l'effet d'ion commun.(Exemple : dissolution de KCl dans une solution où sont déjà introduits les ions Cl–).
- Le pH peut aussi fortement influencer la solubilité de certains produits[1].
Ces facteurs peuvent agir synergiquement entre eux.
Prédiction de la solubilité par contribution de groupe
Les chimistes peuvent estimer l'efficacité d'un mélange en déterminant les paramètres de solubilité du solvant et du soluté, appelés généralement « paramètres d'Hildebrand ». Ces paramètres sont relativement approximatifs et n'ont cessé d'être soumis à diverses améliorations, les plus connues étant les paramètres de Hansen, van Krevelen ou Stefanis.
Notes et références
- ↑ Grambow B, MICHEL N (2006) Solubilité des solides dans l’eau : propriété de surface ou du solide ? ; Les 6èmes Journées Scientifiques de Marcoule 15 – 19 mai 2006 1/53 Subatech, Nantes
Voir aussi
Articles connexes
- Produit de solubilité
- Solution (chimie)
- Liste de solubilités et de pKs de sels dans l'eau
Bibliographie
- Grambow B, MICHEL N (2006) Solubilité des solides dans l’eau : propriété de surface ou du solide ? ; Les 6èmes Journées Scientifiques de Marcoule 15 – 19 mai 2006 1/53 Subatech, Nantes
- Portail de la chimie